¿Qué es la hibridación de orbitales?
Se puede definir como la unión de varios orbitales atómicos con el propósito de generar nuevos orbitales, con la diferencia de que estos tendrán el mismo tamaño, misma energía y serán mucho más estables que los anteriores.
Orbital átomico: Es una zona o región donde existe una mayor probabilidad de encontrar al electrón.
- Orbitales átomicos puros: Se representan con las letras s, p, d, f. En el caso de la hibridación del carbono, los orbitales que se utilizan son el orbital s y orbital p.
- Orbital s: Se puede ver expresada de forma esferica y simetrica alrededor del núcleo.
CC por Wikimedia Commons
- Orbital p: Se observa de forma ovoide, localizados en los ejes x, y y z de un grafico cartesiano, por lo que para referirnos a cada uno de ellos los nombraremos como px, py y pz.
CC por Wikimedia Commons
- Orbitales átomicos híbridos: sp3, sp2, sp.
- Orbital híbrido sp3: Es la unión de un orbital s y tres orbitales p, dando como resultado cuatro orbitales sp3. Cada orbital sp3 tiene 25% de carácter s y 75% de caracter p.
- Orbital híbrido sp2: Es la unión de un orbital s y dos orbitales p, dando como resultado tres orbitales sp2. Cada orbital sp2 tiene 33% de carácter s y 67% de carácter p.
- Orbital híbrido sp: Es la unión de un orbital s y un orbitale p, dando como resultado dos orbitales sp. Cada orbital sp tiene 50% de carácter s y 50% de carácter p.
Enlace sigma (σ) y pi (π)
Enlace sigma (σ):
- Tipo de enlace covalente.
- Formado por el solapamiento FRONTAL en orbitales s y p.
- Enlace de alta energía.
- Tiene una libre rotación.
- Solamente puede existir un enlace entre dos átomos.
Enlace pi (π):
- Tipo de enlace covalente.
- Formado por el solapamiento FRONTAL en orbitales s y p.
- Enlace de alta energía.
- Tiene una libre rotación.
- Solamente puede existir un enlace entre dos átomos.
Enlace pi (π):
- Tipo de enlace covalente.
- Formado por el solapamiento LATERAL de orbitales p.
- Posee menor energía que el sigma.
- No permite una libre rotación.
- Pueden existir uno o dos enlaces entre dos átomos.
¿Qué significan los enlaces sigma y pi en la hibridación?Estos de pueden observar cuando el carbono forma enlaces sencillos, dobles y triples:- Los enlaces sencillos se conforman de UN enlace SIGMA. Se observan en moléculas donde el átomo central presenta una hibridación sp3.
- Los enlaces dobles se conforman de UN enlace SIGMA y UN enlace PI. Se observan en moléculas donde el átomo central presenta una hibridación sp2.
- Los enlaces triples se conforman de UN enlace SIGMA y DOS enlaces PI. Se observan en moléculas donde el átomo central presenta una hibridación sp.
¿Cómo se forman los orbitales híbridos?
Se hibrídan:- Los orbitales atómicos que van a formar enlaces sigma.
- Las parejas de electrones sin compartir.
No se hibrídan:- Los orbitales atómicos que van a formar el segundo o tercer enlace.
- Los orbitales atómicos vacios.
Para la formación de orbitales híbridos es necesario tomar en cuenta la configuración electronica del carbono:C = 1s2, 2s2, 2p2
CC por Wikimedia Commons
Conceptos a tener en cuenta:- Estado fundamental o basal: Es cuando un átomo o molécula se encuentra en su nivel más bajo de energía, donde si no se le administra energía este permanecerá en dicho estado. En otras palabras es el estado más puro en el que se puede encontrar el átomo o molécula.
- Estado excitado: Este estado hace referencia a cuando el átomo en cuestión recibe energía del exterior, la cual es transferida a uno de sus electrones, en consecuencia, al no tener la misma energía que los demás electrones, este saltará al siguiente nivel de energía para poder adaptarse bien.
Hibridación sp3: metano.
CC por Wikimedia Commons
- Paso 1: En primer lugar, se consider la configuración electronica del carbono en su estado basal.
- Paso 2: En el estado basal, el carbono no tendrá la libertad de formar los cuatro enlaces C-H que requiere para el metano, por lo que es necesario que pase a un estado excitado.
- Paso 3: Una vez que el carbono pasa al estado excitado, está preparado para formar sus cuatro enlaces, sin embargo, estos enlaces son distintos (un enlace s y tres enlaces p), por lo que estos no serían equivalentes tanto en energía como en tamaño, así que es necesario que los cuatro orbitales se combinen, para formar enlaces similares.
- Paso 4: Al combinar un enlace s con tres enlaces p dan como resultado cuatro enlaces sp3, con misma energía y tamaño, con una geometría molecular tetraédrica, con angulos de 109,5º entre cada enlace.
Hibridación sp2: etileno/eteno.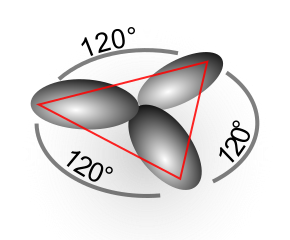
CC por Wikimedia Commons
- Paso 1: Se consider la configuración electronica del carbono en su estado basal.
- Paso 2: En el estado basal, el carbono no tendrá la libertad de formar los cuatro enlaces C-H que requiere, por lo que es necesario que pase a un estado excitado.
- Paso 3: Una vez que el carbono pasa al estado excitado, está preparado para formar sus cuatro enlaces, sin embargo, estos enlaces son distintos (un enlace s y tres enlaces p), por lo que estos no serían equivalentes tanto en energía como en tamaño.
- Paso 4: A diferencia de la hibridación sp3, la hibridación sp2 es característica por formar dobles enlaces, para hacer esto posible el carbono necesita tener un orbital p sin hibridar.
- Al combinar un enlace s con dos p dan como resultado tres enlaces sp2 más el orbital p sin hibridar, pudiendo así formar un doble enlace entre los carbonos. La hibridación sp2 tiene una geometría molecular triangular plana, con angulos de 120º entre cada enlace.
Hibridación sp: acetileno/etino.
CC por Wikimedia Commons
- Paso 1: Se consider la configuración electronica del carbono en su estado basal.
- Paso 2: En el estado basal, el carbono no tendrá la libertad de formar los cuatro enlaces C-H que requiere, por lo que es necesario que pase a un estado excitado.
- Paso 3: Una vez que el carbono pasa al estado excitado, está preparado para formar sus cuatro enlaces, sin embargo, estos enlaces son distintos (un enlace s y tres enlaces p), por lo que estos no serían equivalentes tanto en energía como en tamaño.
- Paso 4: La hibridación sp es característica por formar enlaces triples y para que estos sea posible es necesario tener dos orbitales p sin hibridar.
- Al combinar un enlace s y uno p dan como resultado enlaces sp más los dos orbitales p sin hibridar, pudiendo así formar un triple enlace entre los carbonos. La hibridación sp tiene una geometría molecular lineal, con angulos de 180º entre cada enlace.
REFERENCIAS BIBLIOGRAFICAS:
- Tipo de enlace covalente.
- Formado por el solapamiento LATERAL de orbitales p.
- Posee menor energía que el sigma.
- No permite una libre rotación.
- Pueden existir uno o dos enlaces entre dos átomos.
¿Qué significan los enlaces sigma y pi en la hibridación?
Estos de pueden observar cuando el carbono forma enlaces sencillos, dobles y triples:
- Los enlaces sencillos se conforman de UN enlace SIGMA. Se observan en moléculas donde el átomo central presenta una hibridación sp3.
- Los enlaces dobles se conforman de UN enlace SIGMA y UN enlace PI. Se observan en moléculas donde el átomo central presenta una hibridación sp2.
- Los enlaces triples se conforman de UN enlace SIGMA y DOS enlaces PI. Se observan en moléculas donde el átomo central presenta una hibridación sp.
¿Cómo se forman los orbitales híbridos?
Se hibrídan:
- Los orbitales atómicos que van a formar enlaces sigma.
- Las parejas de electrones sin compartir.
No se hibrídan:
- Los orbitales atómicos que van a formar el segundo o tercer enlace.
- Los orbitales atómicos vacios.
Para la formación de orbitales híbridos es necesario tomar en cuenta la configuración electronica del carbono:
C = 1s2, 2s2, 2p2
 |
| CC por Wikimedia Commons |
Conceptos a tener en cuenta:
- Estado fundamental o basal: Es cuando un átomo o molécula se encuentra en su nivel más bajo de energía, donde si no se le administra energía este permanecerá en dicho estado. En otras palabras es el estado más puro en el que se puede encontrar el átomo o molécula.
- Estado excitado: Este estado hace referencia a cuando el átomo en cuestión recibe energía del exterior, la cual es transferida a uno de sus electrones, en consecuencia, al no tener la misma energía que los demás electrones, este saltará al siguiente nivel de energía para poder adaptarse bien.
Hibridación sp3: metano.
 |
| CC por Wikimedia Commons |
- Paso 1: En primer lugar, se consider la configuración electronica del carbono en su estado basal.
- Paso 2: En el estado basal, el carbono no tendrá la libertad de formar los cuatro enlaces C-H que requiere para el metano, por lo que es necesario que pase a un estado excitado.
- Paso 3: Una vez que el carbono pasa al estado excitado, está preparado para formar sus cuatro enlaces, sin embargo, estos enlaces son distintos (un enlace s y tres enlaces p), por lo que estos no serían equivalentes tanto en energía como en tamaño, así que es necesario que los cuatro orbitales se combinen, para formar enlaces similares.
- Paso 4: Al combinar un enlace s con tres enlaces p dan como resultado cuatro enlaces sp3, con misma energía y tamaño, con una geometría molecular tetraédrica, con angulos de 109,5º entre cada enlace.
Hibridación sp2: etileno/eteno.
 |
| CC por Wikimedia Commons |
- Paso 1: Se consider la configuración electronica del carbono en su estado basal.
- Paso 2: En el estado basal, el carbono no tendrá la libertad de formar los cuatro enlaces C-H que requiere, por lo que es necesario que pase a un estado excitado.
- Paso 3: Una vez que el carbono pasa al estado excitado, está preparado para formar sus cuatro enlaces, sin embargo, estos enlaces son distintos (un enlace s y tres enlaces p), por lo que estos no serían equivalentes tanto en energía como en tamaño.
- Paso 4: A diferencia de la hibridación sp3, la hibridación sp2 es característica por formar dobles enlaces, para hacer esto posible el carbono necesita tener un orbital p sin hibridar.
- Al combinar un enlace s con dos p dan como resultado tres enlaces sp2 más el orbital p sin hibridar, pudiendo así formar un doble enlace entre los carbonos. La hibridación sp2 tiene una geometría molecular triangular plana, con angulos de 120º entre cada enlace.
Hibridación sp: acetileno/etino.
 |
| CC por Wikimedia Commons |
- Paso 1: Se consider la configuración electronica del carbono en su estado basal.
- Paso 2: En el estado basal, el carbono no tendrá la libertad de formar los cuatro enlaces C-H que requiere, por lo que es necesario que pase a un estado excitado.
- Paso 3: Una vez que el carbono pasa al estado excitado, está preparado para formar sus cuatro enlaces, sin embargo, estos enlaces son distintos (un enlace s y tres enlaces p), por lo que estos no serían equivalentes tanto en energía como en tamaño.
- Paso 4: La hibridación sp es característica por formar enlaces triples y para que estos sea posible es necesario tener dos orbitales p sin hibridar.
- Al combinar un enlace s y uno p dan como resultado enlaces sp más los dos orbitales p sin hibridar, pudiendo así formar un triple enlace entre los carbonos. La hibridación sp tiene una geometría molecular lineal, con angulos de 180º entre cada enlace.
REFERENCIAS BIBLIOGRAFICAS:
Díez Tascón, J. M. (2007). Materiales de carbono: estructuras y formas.
FERNANDO, B. M. HIBRIDACIÓN DEL CARBONO.
LQL Luis Química León. (2018, 9 de junio). HIBRIDACIÓN - PARTE I [Video]. https://www.youtube.com/watch?v=aMZAfH8YEF4&t=174s
Sánchez, J., Calderón, Z., & García, M. L. (2017). Tipos de hibridación del átomo de carbono.















No hay comentarios.:
Publicar un comentario